Мультиспиральная компьютерная ангиография в оценке сосудистой анатомии печени родственных доноров
Федеральное Государственное бюджетное учреждение «ФНЦ им. ак. Шумакова» Минздравсоцразвития России ()
РЕФЕРАТ: Цель работы – оптимизировать методические подходы к исследованию и оценке печеночных артерий, портальных и печеночных вен перед резекцией фрагмента печени у родственного донора, систематизировать полученные данные о кровоснабжении печени. Было обследовано 200 потенциальных доноров фрагмента печени. Применялся томограф Somatom «Sensation-64» фирмы Siemens, протокол мультифазного сканирования. Показаны высокие диагностические возможности компьютерной томографии c контрастированием в визуализации артериального и венозного кровоснабжения печени.
КЛЮЧЕВЫЕ СЛОВА: мультиспиральная компьютерная томография, печень, анатомия артериальной системы, анатомия венозной системы.
Введение
Медицинская практика и многочисленные исследования отечественных и зарубежных авторов свидетельствуют о наличии большого числа больных, страдающих неизлечимыми заболеваниями печени, в терапии которых применяются малоэффективные общеизвестные способы коррекции проявлений печеночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза, а также химиотерапия при нерезектабельных опухолевых поражениях [2].
Единственным радикальным методом эффективного лечения больных, в том числе детского возраста, с терминальной стадией печеночной недостаточности является трансплантация печени от живого родственного донора [5].
Поскольку операция резекции печени несет определенный риск, важным аспектом подобного хирургического вмешательства является подробное изучение анатомических особенностей кровоснабжения печени, влияющих на тактику и стратегию проведения хирургического вмешательства. До появления МСКТ-ангиографии основным средством изучения сосудистого строения печени была мезентерико-целиако-портография. Основными недостатками методики являлись большая инвазивность методики, значительный объем вводимого контрастного препарата, высокий риск возникновения осложнений (кровотечения, травматической аневризмы бедренной артерии, тромбоэмболии, невралгии, аллергических реакций и т.д.).
МСКТ-ангиография – методика малоинвазивная, требует небольшого количества контрастного препарата, занимает непродолжительное время, а получаемые высокоинформативные изображения удобны для интерпретации данных [4]. Данные МСКТ о кровоснабжении печени имеют важное значение при планировании операции ее резекции [4]. Корректное описание анатомических структур области интереса позволяет правильно планировать подобное хирургическое вмешательство [9]. МСКТ-ангиография в широкой практике применяется сравнительно недавно, постоянно совершенствуется программное обеспечение томографов, включая трехмерные реконструкции. В связи с необходимостью получения четких изображений сосудистых структур, подбора оптимальных параметров проведения исследований, совершенствования методики оценки полученных данных была предпринята данная работа.
Цель работы – оптимизировать методические подходы к исследованию и оценке печеночных артерий, портальных и печеночных вен перед резекцией фрагмента печени у родственного донора, систематизировать полученные данные о кровоснабжении печени.
Материалы и методы
Было обследовано 200 потенциальных доноров фрагмента печени (109 мужчин и 91 женщина) в возрасте от 19 до 54 лет, средний возраст которых составил 34,1±9,06 года. Доноры правой доли печени – 86 человек, левого латерального сектора – 114 человек.
МСКТ выполнялось на приборе Somatom «Sensation-64» фирмы Siemens. Для внутривенного контрастирования применялся автоматический шприц инжектор фирмы Medrad, с использованием неионного контрастного препарата (с содержанием йода 350-370 мг/мл) в дозе 80-110 мл со скоростью введения 4,5-5,0 мл/с. Болюс (контраст) отслеживался автоматически при помощи программы Bolus Tracking с установкой точки «Trigger» на нисходящую аорту для обеспечения точных сроков наступления артериальной фазы.
Протоколом выбора явился мультифазный протокол сканирования с подобранными параметрами, который включал в себя нативное исследование, артериальную, портальную и отсроченную фазы (фаза печеночных вен) сканирования, выполненные на одной задержке дыхания в каждую из фаз. Постпроцессинг осуществлялся на 3D карте, где представлены следующие виды реконструкций: MPR (мультипланарные реконструкции), MIP (проекции максимальных интенсивностей), VRT (объемное представление объекта).
Результаты
Изучая возможности МСКТ в обследовании доноров фрагмента печени и подбирая параметры сканирования, было определено, что оптимальное контрастирование брюшной аорты и ее ветвей (артериальная фаза) достигалось на 15-20 секунде сканирования с того момента, когда усиление в аорте в установленной точке «Trigger» достигало +120 HU. В фазе портальной вены, которая наступала на 30-40-й секунде исследования от начала введения болюса, усиление в аорте быстро уменьшалось, а в системе воротной вены и паренхиме печени максимально возрастало, что давало возможность визуализировать систему воротной вены. На 50-60 секунде исследования наступала отсроченная фаза, оптимальная для визуализации печеночных вен и нижней полой вены.
Для систематизации классической и вариантной сосудистой анатомии печени была использована классификация С.В. Готье и соавт., основанная на патологоанатомических исследованиях, выполненных в РНЦХ имени Б.В. Петровского.
Полученные данные по артериальному кровоснабжению печени представлены в табл. 1.
Пример артериальной анатомии (смешанный тип) показан на рис. 1, который наиболее полно отражает возможные варианты кровоснабжения печени.
Таблица 1. СКТ-артериография в определении вариантов артериального кровоснабжения печени.
| Вариант артериальной анатомии (ВАК) | Кол-во чел. | % |
|---|---|---|
| I. Классическая анатомия (отхождение правой и левой долевой артерии от собственно печеночной) | 109 | 54.5±3.6 |
| II. Отсутствие собственно печеночной артерии | 23 | 11.5±2.3 |
| III. Наличие ветви от левой желудочной артерии к 2 и 3 сегментам | 32 | 16.0±2.6 |
| IV. Участие верхней брыжеечной артерии в кровоснабжении печени | ||
| А) общая печеночная отходит от верхней брыжеечной, левых дополнительных ветвей нет | 5 | 2.5±1.1 |
| Б) правая доля печени кровоснабжается из верхней брыжеечной, левая доля питается из собственно печеночной артерии | 18 | 9.0±2.0 |
| В) общая печеночная отходит от верхней брыжеечной, левых дополнительных ветвей нет | 3 | 1.5±0.9 |
| V. Смешанный тип кровоснабжения. Правая доля питается из системы верхней брыжеечной артерии. Левая доля питается в основном из собственно печеночной артерии (система чревного ствола). 2 и 3 сегменты дополнительно питаются от левой желудочной артерии | 6 | 3.0±1.2 |
| VI. Варианты, не вошедшие в данную классификацию: А) Левая долевая артерия отходит от собственно печеночной артерии, правая доля кровоснабжается от чревного ствола |
4 | 2.0±0.9 |
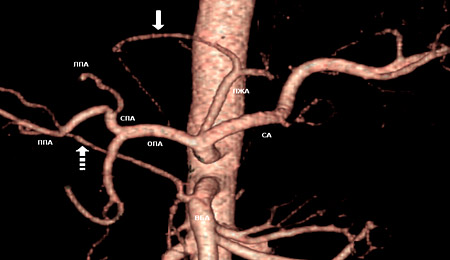
Рисунок 1. Смешанный тип кровоснабжения печени.
ОПА – общая печеночная артерия, СПА – собственно печеночная артерия, ЛПА – левая долевая артерия, ППА – правая долевая артерия, ЛЖА – левая желудочная артерия, СА – селезеночная артерия, ВБА – верхняя брыжеечная артерия. Дополнительная ветвь к II и III сегментам левой доли – сплошная стрелка. Правая доля получает дополнительный сосуд от верхней брыжеечной артерии – пунктирная стрелка.
На рисунке 2 продемонстрирован тип VI, не вошедший в использованную классификацию.
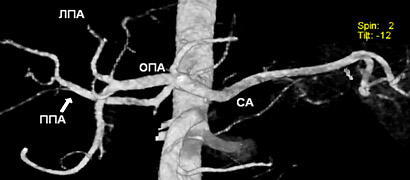
Рисунок 2. Отхождение правой долевой артерии от чревного ствола.
ПА – общая печеночная артерия, ЛПА – левая печеночная артерия, ППА – правая печеночная артерия,
СА – селезеночная артерия.
В составе исследования артериального кровоснабжения печени были прослежены и систематизированы типы кровоснабжения IV сегмента. Были определены три основных варианта кровоснабжения IV сегмента и два редко встречающихся. Варианты кровоснабжения IV сегмента перечислены в таблице 2.
Таблица 2. МСКТ-артериография в определении вариантов артериального кровоснабжения IV сегмента.
| Варианты кровоснабжения IV сегмента печени | Кол-во чел. | % |
|---|---|---|
| I. Кровоснабжение от левой долевой артерии (L) | 138 | 69.0±3.3 |
| II. Кровоснабжение от правой долевой артерии (R) | 27 | 13.5±2.4 |
| III. 4-й сегмент получает два сосуда: от правой и левой доли (LR) | 25 | 12.5±2.7 |
| IV. Собственно печеночная артерия делится на три ветви, средняя из которых питает 4-й сегмент | 3 | 1.5±0.8 |
| V. 4 сегмент кровоснабжается левой печеночной артерией, 2 и 3 сегменты – отдельной ветвью от левой желудочной артерии, правая доля питается от правой печеночной артерии | 7 | 3.5±1.3 |
На рисунках 3, 4, 5 представлены наиболее редко встречающиеся типы кровоснабжения IV сегмента печени.
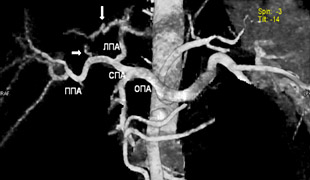
Рисунок 3. Двойное кровоснабжение IV сегмента.
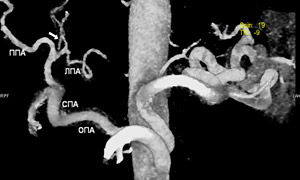
Рисунок 4. Кровоснабжение IV сегмента от собственно печеночной артерии.
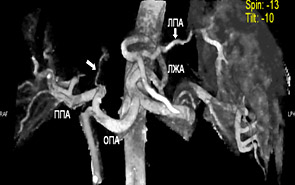
Рисунок 5. IV сегмент питался посредством левой печеночной артерии.
ОПА – общая печеночная артерия, ЛПА – левая печеночная артерия, ППА – правая печеночная артерия,
СПА – собственно печеночная артерия, ЛЖА – левая желудочная артерия.
При обобщении вариантов ветвления воротной вены (ВВ) были выделены четыре описанных типа ветвления воротной вены:
- классический тип (бифуркация) выявился у 173 обследованных, что составило 86,5%;
- трифуркация выявилась у 10 человек (5,0%);
- транспозиция правых парамедианных вен – у 14 человек (7,0%);
- сочетание бифуркации воротной вены с наличием мелких ветвей – у 3 доноров (1,5%).
Пример трифуркации ВВ, транспозиции правых парамедианных вен показан на рис. 6, 7.
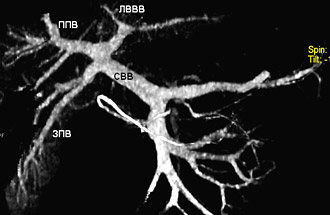
Рисунок 6. Схема транспозиции правых парамедианных вен.
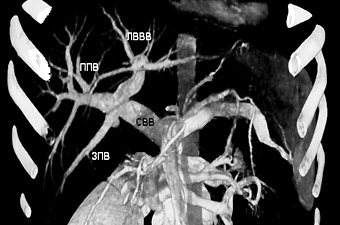
Рисунок 7. Схема трифуркации воротной вены.
СВВ – ствол воротной вены, ЛВВВ – левая ветвь воротной вены,
ППВ – передняя правая ветвь, ЗПВ – задняя правая ветвь.
При изучении анатомии печеночных вен было выделено три основных встречающихся варианта кавального оттока печени:
- Раздельное впадение правой, срединной и левой печеночных вен было определено в 50,5±3,5% случаев.
- Наличие правой печеночной вены и общего устья срединной и левой печеночных вен – в 30,0±2,8% случаев.
- Наличие правой печеночной вены и общего ствола срединной и левой печеночной вены – в 20,5±2,8% случаев.
Основные полученные варианты кавального оттока печени показаны на рис. 8, 9, 10.
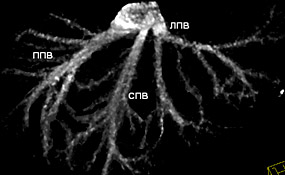
Рисунок 8. Раздельное впадение печеночных вен.
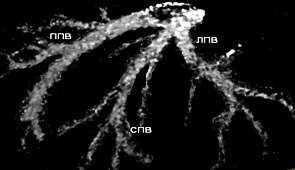
Рисунок 9. Общее устье срединной и левой печеночных вен.
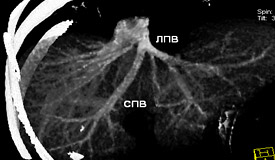
Рисунок 10. Общий ствол срединной и левой печеночных вен.
ЛПВ – левая печеночная вена, СПВ – срединная печеночная вена, ППВ – правая печеночная вена.
В зависимости от планируемого для резекции фрагмента печени внимание уделялось выявлению дополнительных вен печени, самостоятельно впадающих в НПВ от правой и левой доли. Наличие ветви от VIII сегмента печени в срединную вену наблюдалось у 53 человек – 9.5±2.1% случаев. Дополнительная нижняя правая ветвь от V либо VI сегментов правой доли встречалась у 34 человек – 17.0±2.7 случаев. Ветвь от II сегмента печени, самостоятельно впадающая в НПВ, наблюдалась у 19 человек – 9.5±2.1% случаев. У 12 человек было определено наличие дополнительной верхней правой печеночной вены. На рисунках 11, 12, 13, 14 показаны обнаруженные типы дополнительных вен печени.
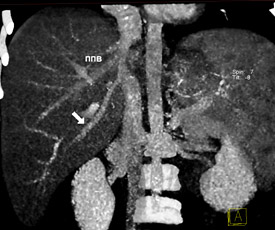
Рисунок 11. Дополнительная нижняя правая вена печени.
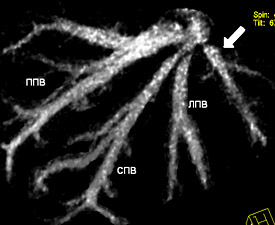
Рисунок 12. Самостоятельная ветвь от II сегмента в НПВ.
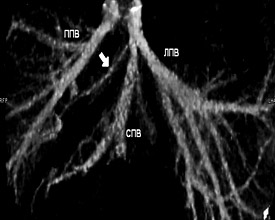
Рисунок 13. Наличие ветви от VIII сегмента в срединную вену.
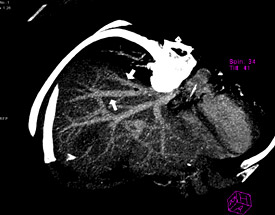
Рисунок 14. Наличие верхней правой ветви от II сегмента.
На момент проведения настоящего исследования 80-ти (40%) из 200 обследованных потенциальных доноров была проведена операция по забору фрагмента печени. С целью получения в качестве трансплантата левого латерального сектора (ЛЛС) резекция была выполнена у 48 (60%) человек, правой доли (ПД) – у 32 (40%) человек. В зависимости от антропометрических данных реципиента определялся способ резекции у донора. ЛЛС предназначался для младшего детского возраста, правая доля – от взрослого взрослому. Полученные результаты по артериальному, портальному, венозному кровоснабжению печени сравнивали с интраоперационными находками для выяснения диагностической информативности метода МСКТ.
Сопоставление с операционными данными показало высокую чувствительность МСКТ с болюсным контрастным усилением в первичной оценке ангиоархитектоники сосудов печени родственного донора: печеночных артерий – до 98,2%, анатомии портальной вены – 96,7%, основных путей венозного оттока – 96,3%, 95,0% дополнительных вен печени.
Обсуждение
Внедрение в клиническую практику МСКТ кардинальным образом изменило диагностические подходы к обследованию пациентов в абдоминальной хирургии, особенно при родственной трансплантации печени, поскольку этот метод практически полностью заменил рентгеновскую контрастную ангиографию, что отмечается большинством авторов, работающих в этой области [3,5,8]. Метод достаточно прост для пациента, так как контрастное вещество вводится внутривенно в объеме, не превышающем 100 мл, а использование неионных (изоосмолярных) контрастных средств минимизирует их побочное действие, а именно нефротоксичность [4]. В наших исследованиях не наблюдалось каких-либо побочных реакций у пациентов при введении контрастного препарата.
Параметры проведения исследования индивидуальны для каждого класса приборов. В проведенном исследовании параметры сканирования подбирались на основании диагностического изображения в каждую из полученных фаз, достигнув тем самым наилучшей контрастности, удобной для интерпретации данных.
Использование MPR реконструкций позволяло снизить шум в изображении, MIP реконструкции были пригодны для визуализации мелких сосудов области интереса, VRT или объемное представление объекта дозволяло строить объемные 3D модели, отражающие сосудистую анатомию печени.
Анатомия артериального кровоснабжения весьма вариабельна. Существует множество классификаций, используемых для систематизации получаемых данных. Наиболее популярная – по N Michels. При изучении артериального кровоснабжения печени определялся основной источник ее кровоснабжения – общая печеночная артерия, собственно печеночная артерия, виды отхождения правой и левой долевых артерий. Также внимание уделялось наличию ветвей от левой желудочной и верхней брыжеечной артерий. При сравнении данных МСКТ с операционными данными у 80 человек в одном случае отмечались разногласия, а именно отсутствие собственно печеночной артерии, интраоперационно было описано как классический тип. Это было связано с малой длиной СПА.
Систематизируя полученные данные по артериальному кровоснабжению печени, были отмечены все варианты, описанные ранее С.В. Готье и соавт. [2]. В отдельную группу отнесли отхождение правой долевой артерии от чревного ствола.
Благодаря высокой разрешающей способности аппарата, на котором производилось исследование, появилась возможность определить кровоснабжение IV сегмента, что было важно при планировании операции. Оценка типа кровоснабжения IV сегмента позволяет снизить риск послеоперационных осложнений у донора ПД, таких как ишемия обедненной кровотоком оставшейся части печени в раннем постоперационном периоде.
Заблаговременная оценка типа ветвления воротной (ВВ) вены имеет значение при выполнении резекции печени у РДФП, так как определяет плоскость разделения паренхимы [7, 16]. При суммировании данных МСКТ по вариантам ветвления воротной вены были отмечены все группы, отраженные в использованной патологоанатомической классификации. Превалирующее значение при этом занимали пациенты с бифуркацией воротной вены [1, 2]. При изучении анатомии воротной вены особый интерес представлял вариант трифуркации основного ствола (деление основного ствола на три равноценные ветви) и транспозиции парамедианных вен (наличие двух правых ветвей к правой доле) [13]. От заблаговременно описанного варианта ВВ зависел выбор сосудистой вставки на этапе имплантации печени реципиенту. При определении варианта транспозиции воротной вены необходимо измерить расстояние между двумя правыми ветвями, что в совокупности определяет возможность резекции правой доли у донора [15, 16]. В 2 наблюдениях была выявлена гипердиагностика деления ствола воротной вены на три равноценные ветви. Интраоперационно близкое отхождение ветви VI сегмента на этапе обследования было принято за трифуркацию воротной вены [2].
Существующая классификация впадения печеночных вен P. Soyer и соавт. в модификации S. Orgus, M. Tercan является наиболее подробной. При анализе впадения печеночных вен с использованием метода МСКТ, мы, как и большинство авторов, делали акцент на расположение трех основных печеночных вен – правой срединной и левой, вариантах их слияния, определении проекции венозных ветвей относительно ВВ, поскольку это определяло плоскость разделения паренхимы при резекции фрагмента печени. При сравнении данных МСКТ и интраоперационных несовпадения возникли в 3 случаях, в 2 случаях близкое расположение устьев срединной и левой печеночных вен было принято за единое соустье, в 1 случае единый короткий ствол СПВ и ЛПВ был принят за единое соустье.
При планировании операции резекции печени необходимо уделять внимание дополнительным венам печени, следующим от сегментов печени и самостоятельно впадающим в НПВ. Дополнительные вены печени могут пересекать плоскость разделения паренхимы и в отдельных случаях, превосходя диаметр более 5,0 мм, могут повлиять на ход операции [2, 5, 15]. Если данные ветви будут пересечены в соответствующих секторах, может возникнуть венозное полнокровие и поздняя ишемия, компенсирующаяся функционирующим объемом трансплантата. Анализируя венозное кровоснабжение печени, были выделены четыре основных вида дополнительных вен печени (рис. 11, 12, 13, 14). В 10 случаях описанные варианты встречались в различных комбинациях.
Таким образом, корректная оценка сосудистой анатомии печени является важным диагностическим критерием, который определяет возможность и ход проведения оперативного вмешательства по резекции фрагмента печени.
В настоящий момент времени метод МСКТ играет главенствующую роль в обследовании доноров фрагмента печени и, по мнению многих отечественных и зарубежных исследователей, является экспертным в изучении анатомических особенностей кровоснабжения печени, что делает его применение целесообразным для печеночной хирургии в целом.
Литература
- Балахнин П.В., Таразов П.Г., Поликарпов П.А. и др. Варианты артериальной анатомии печени по данным 1511 ангиографий // Анн. хир. гепатол. 2004. 9(2), C.14-21.
- Готье С.В., Константинов Б.А., Цирульникова О.М. Трансплантация печени: Руководство для врачей. 2008. С.15-91.
- Егоров В.И., Яшина Н.И., Кармазановский Г.Г., Федоров А.В. КТ-ангиография как надежный метод верификации заболеваний, вариантов строения и послеоперационных изменений артерий целиако-мезентериального бассейна. // Медицинская визуализация. 2009. №3, C.82.
- Кармазановский Г.Г. Спиральная компьютерная томография с болюсным контрастным усилением в абдоминальной хирургии. // Медицинская визуализация. 2004. С.17
- Ким Э.Ф. Клинические и хирургические аспекты прижизненного донорства фрагментов печени // Автореф. дис. д-ра мед. наук. 2008. C.15-131.
- Alonsa-Torrens A., MD Jaime-Cuadro, Inmaculada Pinilla, Manuel Porron, MD Emilio de Vincente, Manuel Lopez Santamria MD. Multidetector CT in the Evaluation of Potential Living Donors for Liver Transplantation // Radiographics. 2005, Jul-Aug; 25(4): 1017-30.
- Couinaud C. Liver anatomy: portal or biliary segmentation // Paris, 1957, 320 p.
- Cheng Y.F., Huang T.L., Chen C.L., Chen Y.S., et al. Variants of the left and middle hepatic veins: application in living related hepatic transplantation // J. Clin. Ultrasound. 1996. V.24, P.11-16.
- Dushyant Sahani, MD, Aparna Mehta, MBBS, DMRE, Michael Blake MD, Srinivasa Prasad, MD, Gordan Harris Preoperative Hepatic Vascular Evaluation with CT and MR Angiography: Implications for Surgery // September, 2004. RadioGraphics. 24, 1367-1380.
- Dushyant S., Aparna M., Michael B., Srinivasa P., Gordan H., Sanjay S. Preoperative Hepatic Vascular with CT and MR Angiography Implications for Surgery // September, 2004. RadioGraphics. 24, P.1367-1380.
- Kamel I.R., Lawler L.P., Fishman E.K. Variations in anatomy of the middle hepatic vein and their impact on normal right hepatectomy // Abdom. Imaging. 2003. 28: 668-674.
- Lee S.G., Hwang S., Kim K.H., et al. Approach to anatomic variations of the graft portal vein in right lobe living-donor liver transplantation // Transplantation. 2003. 75(3 suppl): S28-S32.
- Nakamura T., Tanaka K., Kiuchi T., et al. Anatomical variations and surgical strategies in right lobe living donor liver transplantation: lessons from 120 cases // Transplantation. 2002. 73: 1896-1903.
- Pannu H.K., Maley W.R., Fishman E.K. Liver transplantation: preoperative CT evaluation // RadioGraphics. 2001. 21: S133.
- Soyer P., Bluemke D.A., et al. Variations in the intrahepatiс portions of the hepatic portal veins: Findings on helical CT scans during arterial portography // American Journal of Roentgenology, 1995. v.1964, p.103-108.
- Thayer W.P., Claridge J.A., Pelletier S.J., Oh C.K., Sanfey H.A., Sawyer R.G., et al. Portal vein reconstruction in right lobe living-donor liver transplantation // J. Am. Coll. Surg. 2002. 194: P.96-98.
- Yamaoka Y., Morimoto T., Inamoto T., Tanaka A., Honda K., Ikai I., et al. Safety of the donor in living-related liver transplantation – an analysis of 100 parental donors // Transplantation. 1995. 59:224-226.
